در مقاله قبل توضیحاتی درمورد مجوزهای قابل دریافت از سازمان غذا و دارو ارائه گردید؛ در این مقاله قصد داریم در خصوص CTD و DFM توضیحاتی را ارائه کنیم.
برای ثبت درخواست داروی جدید، نیاز به نگارش پرونده جامع دارویی (CTD) و در برخی موارد طراحی برای تولید (DFM) میباشد. حال در ابتدا به توضیح و تشریح CTD (پرونده جامع دارویی) میپردازیم:
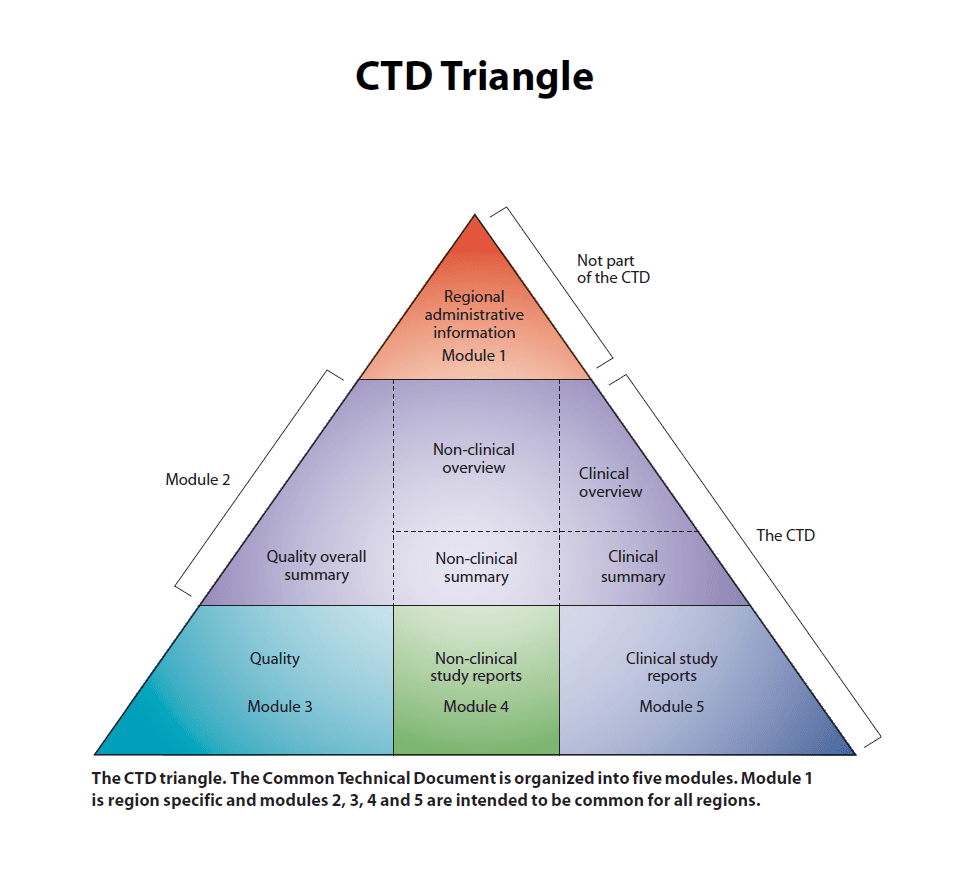
Common Technical Document: پرونده جامع دارویی یک قالب مشترک برای ثبت اطلاعات داروهای جدید در تمام دنیا میباشد. در گذشته، کشورها فرمتهای متفاوتی برای ثبت داروی جدید داشتند؛ این فرمتهای متفاوت، صادرات و واردات دارو را دچار چالش مینمود. به همین جهت یک فرمت مشترک و استاندارد ارائه شد تا شرکتها اطلاعات داروهای جدید را مطابق این فرمت آماده و ارائه کنند. پرونده جامع دارویی به پنج ماژول اصلی تقسیم میشود:
- اطلاعات اداری و تجویزی (Administrative information and prescribing information)،
- خلاصه و مروری از اطلاعات ماژولهای 5-3 (Overviews and summaries of Modules 3–5)،
- کیفیت سنجی(اسناد دارویی) (Quality (pharmaceutical documentation))،
- گزارش مطالعات غیربالینی (Non-clinical reports (pharmacology/toxicology))،
- گزارش مطالعات بالینی (کارآزمایی بالینی) (Clinical study reports (clinical trials))،
در ادامه ماژولها را باهم بررسی میکنیم و اطلاعات بیشتری درمورد هرکدام از آنها کسب میکنیم.
ماژول 1: شامل اطلاعات اداری و اطلاعات مربوط به تجویز دارو شامل فرم درخواست، اطلاعات محصول پیشنهادی و نامگذاری (labelling) میباشد. این ماژول شامل مدارک و اطلاعاتی است که برای هر کشور و منطقه میتواند متفاوت باشد؛ به عنوان مثال نام پیشنهادی جهت استفاده در آن کشور یا منطقه.
ماژول 2: شامل هفت بخش به شرح ذیل میباشد.
- فهرست مطالب (Table of contents)،
- معرفی (Introduction)،
- خلاصه کلی از ماژول کیفیت (Quality Overall Summary)،
- بررسی اجمالی مطالعات غیربالینی (Non-clinical Overview)،
- بررسی اجمالی مطالعات بالینی (Clinical Overview)،
- خلاصه ای ترکیبی از جداول و متن مطالعات غیربالینی (Non-clinical Written and Tabulated Summaries)،
- خلاصه مطالعات بالینی (Clinical Summary)،
ماژول 3: این ماژول شامل اطلاعات کیفی درمورد شیمی، تولید و کنترل محصول دارویی ارائه میکند. اطلاعات بیشتر و جزئیات کامل درخصوص اینکه ماژول 3 شامل چه مواردی میباشد در دستورالعمل ICH M4E آمده است. سرفصلهایی که ذیل این ماژول ارائه میشوند؛ به شرح زیر میباشد:
- فهرست
- مجموعه داده ها که شامل دو بخش اطلاعات کیفی ماده اولیه دارو (Drug Substance) و اطلاعات محصول نهایی (Drug Product) میباشد.
- منابع
ماژول 4: شامل گزارشهای غیربالینی میباشد. این ماژول شامل سرفصلهای فهرست مطالب ماژول 4، گزارش مطالعات، فارماکولوژی، فارماکوکینتیک، سم شناسی و فهرست منابع میباشد.
ماژول5: آخرین ماژول گزارش مطالعات بالینی را شرح میدهد. سرفصلهای این ماژول شامل فهرست مطالب، فهرست جدولی مطالعات بالینی انجام شده، گزارش مطالعات بالینی و فهرست منابع میباشد. لازم به ذکر است فصل گزارش مطالعات بالینی شامل بخشهای گزارش مطالعات بیوفارماسئوتیک، گزارش مطالعات مرتبط با فارماکوکینتیک با استفاده از مواد زیستی انسانی، گزارش مطالعات فارماکوکینتیک (PK) انسانی، گزارش مطالعات فارماکودینامیک انسانی، گزارش مطالعات اثربخشی و ایمنی، گزارشی از تجربه کسب شده بعد از بازاریابی، فرم گزارش موردی و لیست بیماران میباشد.
Design for manufacturing: طراحی برای تولید (DFM) طراحی اجزا و محصولات است که در نهایت به تولید محصولی با کیفیتتر و با هزینه پایینتر منجر میشود. هدف DFM تضمین ساخت و تولید محصول با بهترین کیفیت و کارایی در مقیاس صنعتی است؛ در واقع طراحی برای تولید به مراحل طراحی محصول برای سازگاری با فرآیندهای تولیدی توجه میکند.

